Livmorhalskreft
Behov for ny behandling til pasienter med avansert livmorhalskreft
Livmorhalskreft er på verdensbasis den fjerde mest vanlige kreftformen hos kvinner2, og 345 kvinner fikk livmorhalskreft i Norge i 2021. Antall tilfeller per 100.000 personer er 13,5. Median alder for livmorhalskreft er 46 år, det vil si at halvparten av alle som får diagnosen er under 46 år3.
I Norge har livmorhalskreft gode prognoser og 83 % lever 5 år eller mer etter diagnose3, men ved avanserte stadier er behandlingsalternativene få og prognosene dårlige (ca. 20 % 5-års overlevelse)3.
Forbedret totaloverlevelse og progresjonsfri overlevelse
KEYTRUDA® er en PD-1-hemmer som i kombinasjon med kjemoterapi har vist en statistisk signifikant forbedring i total overlevelse (OS) og progresjonsfri overlevelse (PFS) hos behandlingsnaive pasienter med vedvarende, tilbakevendende eller metastatisk livmorhalskreft der tumor uttrykker PD-L1 med en CPS på 1 eller mer4,5.
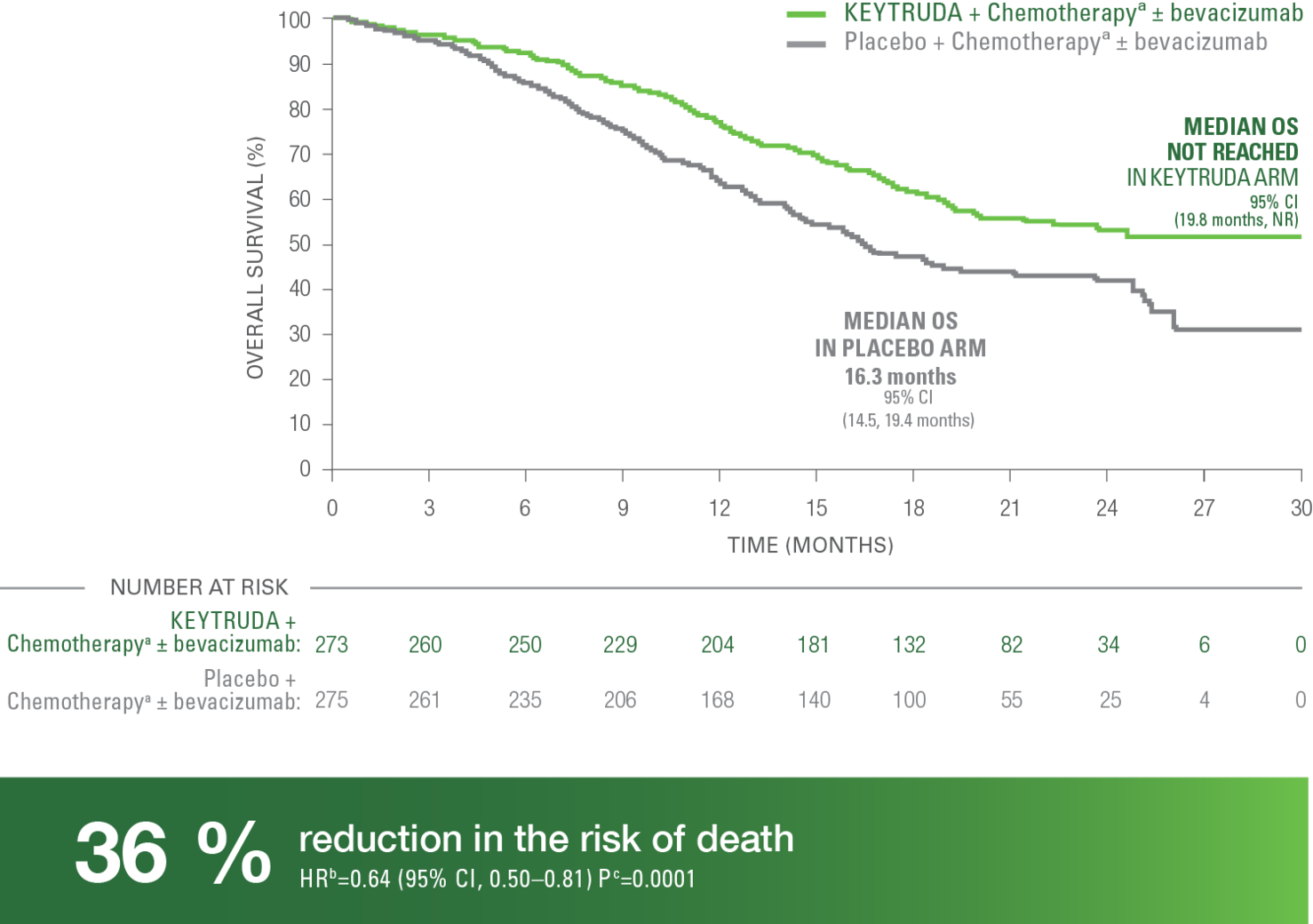
Totaloverlevelse (OS) i populasjonen CPS ≥ 1
I KEYNOTE 826-studien ble median OS ikke nådd hos pasientene med CPS ≥ 1 som mottok KEYTRUDA® sammen med kjemoterapi, med eller uten Bevacizumab (95 % KI, 19,8 måneder – NR). Kjemoterapi alene, med eller uten Bevacizumab, ga en median overlevelse på 16,3 måneder (95 % KI, 14,5–19,4 måneder) (HR = 0,64, 95 KI, 0,50–0,81, p=0,0001).
Median oppfølgingstid i studien var 17,2 måneder (område: 0,3–29,4 måneder)5.
Av pasientene med CPS >1 som fikk KEYTRUDA® sammen med kjemoterapi, med eller uten Bevacizumab, levde 53 % fortsatt etter 2 år. Av pasientene som fikk placebo sammen med kjemoterapi, med eller uten Bevacizumab, levde 41.7 % fortsatt etter 2 år4,5.
Progresjonsfri overlevelse (PFS)
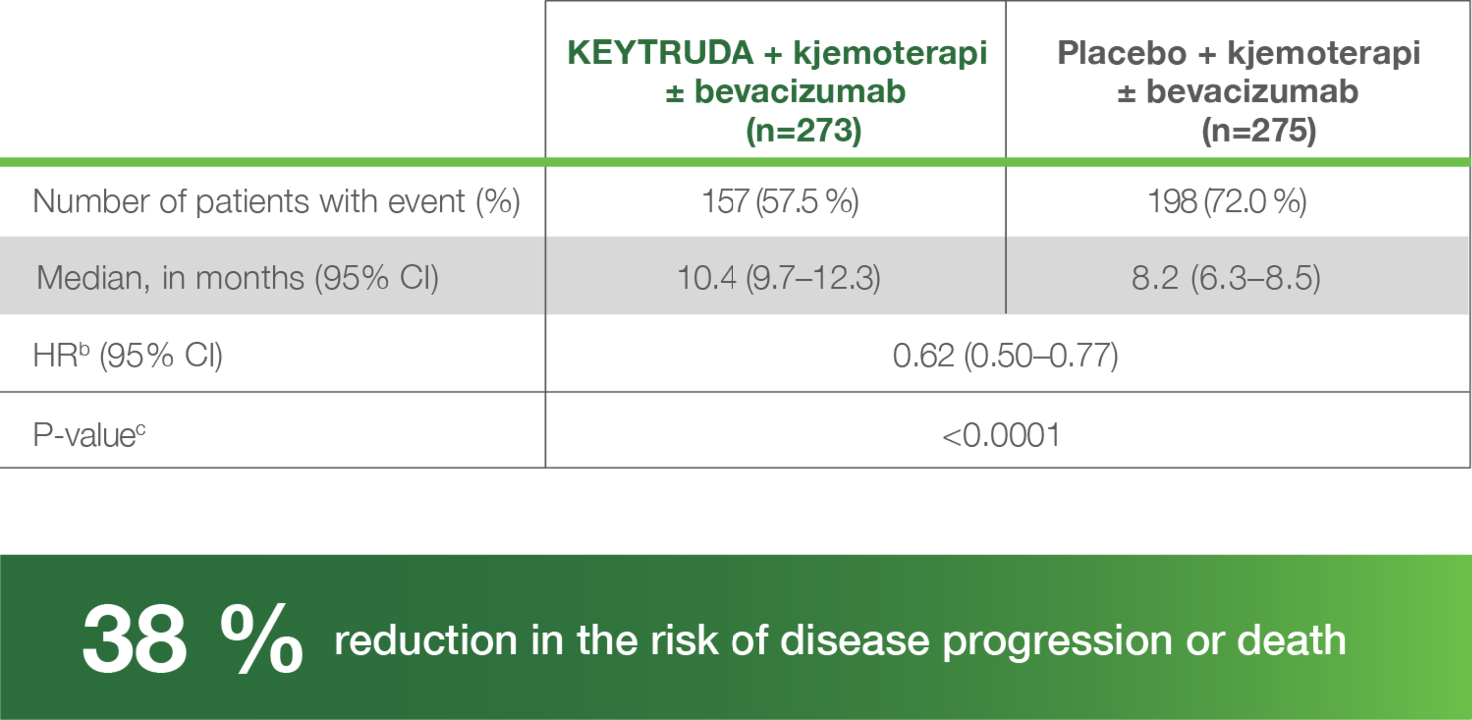
For pasientene som fikk KEYTRUDA® sammen med kjemoterapi, med eller uten Bevacizumab, var median progresjonsfri overlevelse 10,4 måneder i pasientpopulasjonen CPS ≥ 1. For pasientene som fikk kjemoterapi alene, med eller uten Bevacizumab, var median progresjonsfri overlevelse 8,2 måneder4,5.
PFS i populasjonen CPS ≥ 15
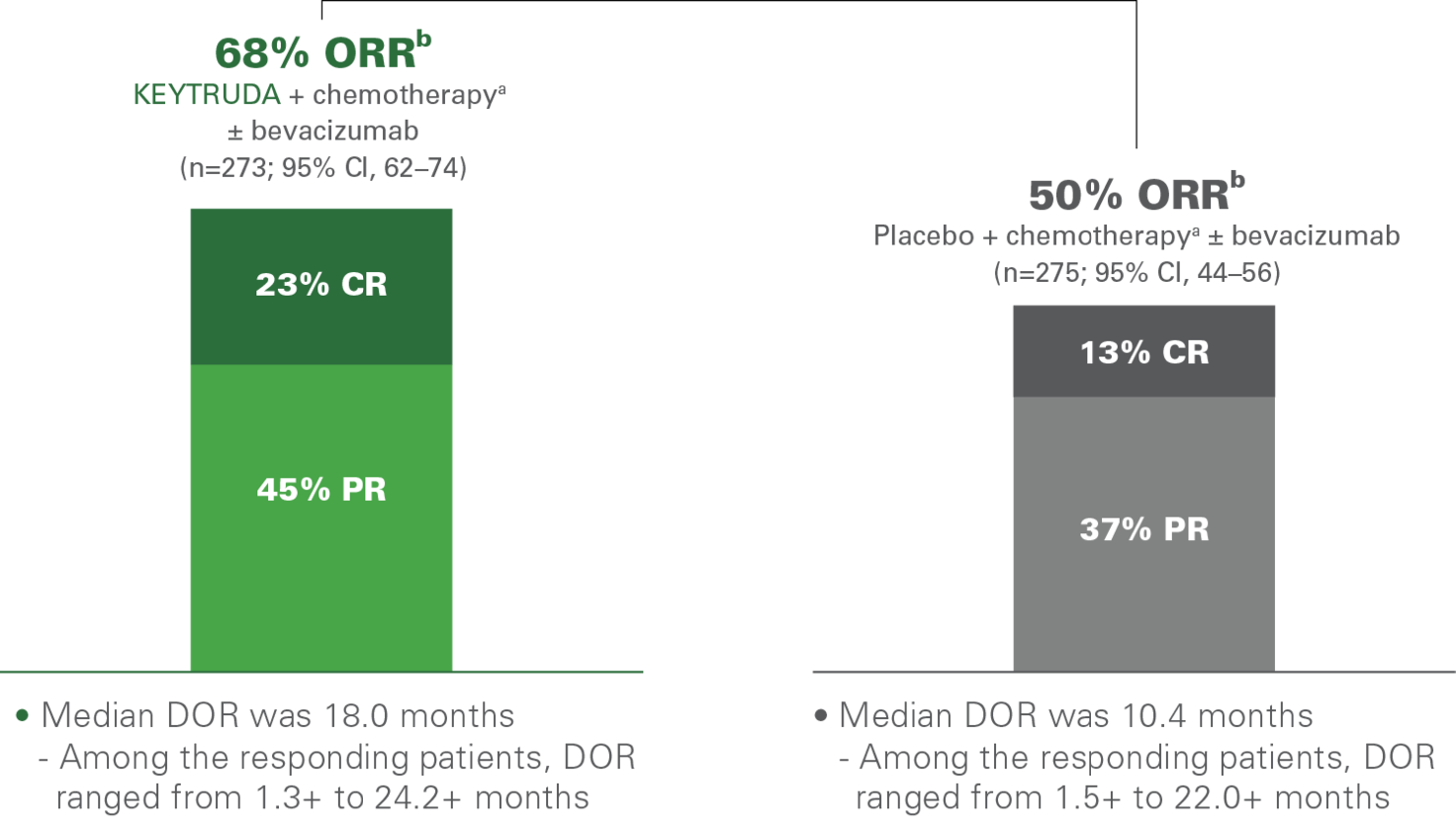
Objektiv Respons Rate (ORR) og median responsvarighet (DOR)4,5
De sekundære endepunktene i KEYNOTE-826 i CPS ≥ 1 populasjon var:
- ORR: 68 % (95 % KI, 62–74 %) og 50 % (95% ki, 44–56 %) i henholdsvis KEYTRUDA® kombinasjonsarm (n=273) og kjemoterapi alene, med eller uten Bevacizumab (n=275).
- DOR: 18,0 måneder (1,3+–24,2+) for KEYTRUDA-kombinasjonen og 10,4 måneder (1,5+–22,0+) med kjemoterapi alene med eller uten Bevacizumab.
Studiedesign KEYNOTE-8264
Godkjenningen er basert på den kliniske studien KEYNOTE-826. Studien inkluderte pasienter uavhengig av PD-L1-uttrykk, men den godkjente indikasjonen gjelder for pasienter med PD-L1-positiv (CPS ≥ 1) livmorhalskreft. Gjennomsnittsalderen på pasientene i studien var 51 år (spredning: 22–82 år). 16 % var 65 år eller eldre. De fleste pasientene i studien (89 %) var PD-L1 positive (CPS ≥ 1), og 63 % fikk tilleggsbehandling med Bevacizumab.
KEYNOTE-826 (n = 617) er en randomisert, dobbeltblind fase 3-studie som undersøkte effekten av KEYTRUDA® i kombinasjon med paklitaksel og cisplatin eller karboplatin, med eller uten Bevacizumab, hos tidligere ubehandlede pasienter med vedvarende, tilbakevendende eller metastatisk livmorhalskreft. Primære endepunkter var OS og PFS og sekundære endepunkter inkluderte ORR, DOR og sikkerhet.
- Primære endepunkter: OS og PFS vurdert i henhold til RECIST v1.1
- Sekundære endepunkter: ORR og DOR vurdert i henhold til RECIST v1.1 og sikkerhet
- Stratifiseringsfaktorer for randomisering:
– Metastatisk status ved første diagnose (ja eller nei)
– Legens valg om å bruke Bevacizumab (ja eller nei)
– PD-L1-uttrykk (CPS < 1 vs 1 til < 10 vs ≥ 10)
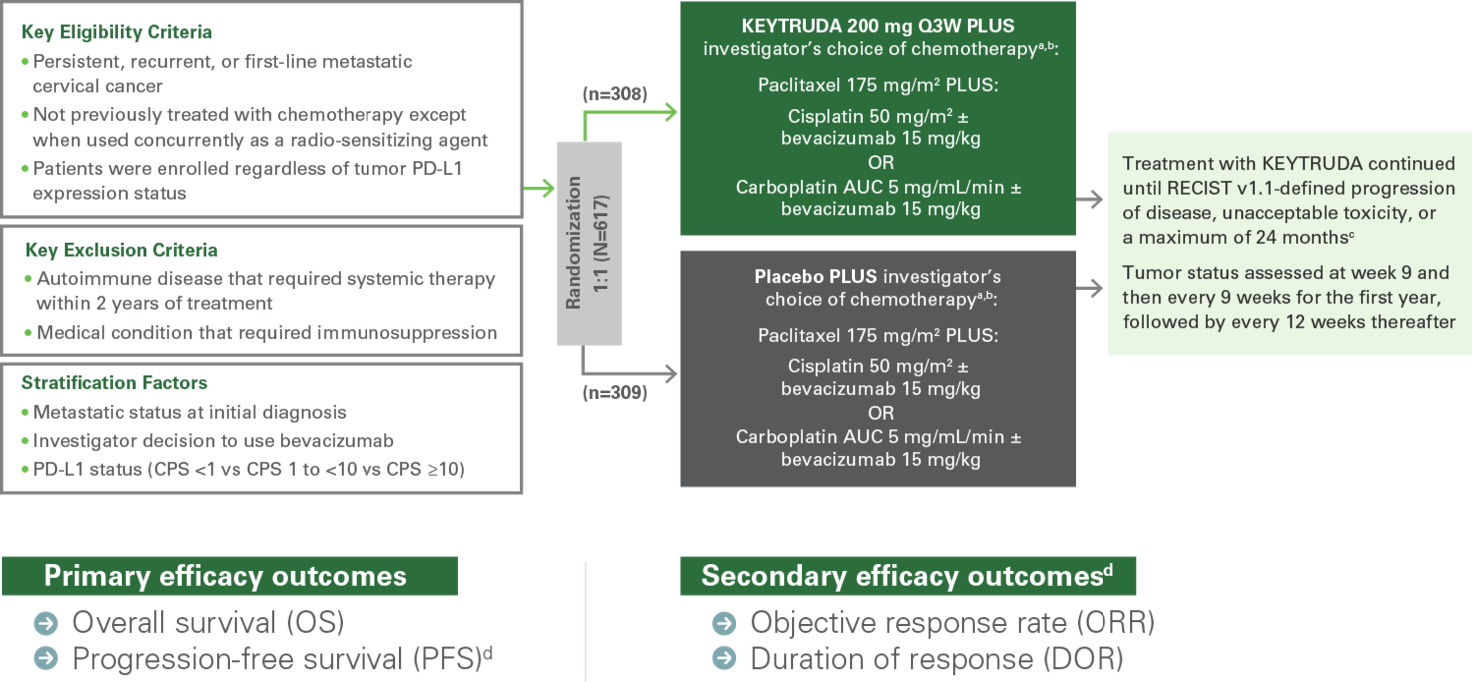
a) All study medications were administered as an intravenous infusion.
b) All study treatments were administered on day 1 of each 3-week treatment cycle. Cisplatin could be administered on day 2 of each 3-week treatment cycle.
c) Administration of KEYTRUDA was permitted beyond RECIST-defined disease progression if patient was clinically stable and considered to be deriving clinical benefit by the investigator.
d) As assessed by investigator according to RECIST v1.1.
Bivirkninger i KEYNOTE-826-studien4
- Alvorlige bivirkninger forekom hos 49,8 % av pasientene i KEYTRUDA-armen sammenlignet med 42,4 % av pasientene i placebo-armen.
- 37,5 % avbrøt behandlingen på grunn av en bivirkning i KEYTRUDA-armen sammenlignet med 26,5 % i placebo-armen.
- 14 pasienter i hver behandlingsarm døde pga uønskede hendelser (henholdsvis 4,6 % og 4,5 %), hvorav 2 hendelser i KEYTRUDA-armen og 4 hendelser i placebo-armen ble ansett å være relatert til behandling.
Adverse Events of Any Cause with an Incidence of 20% or More in Either Group (As-Treated Population).*
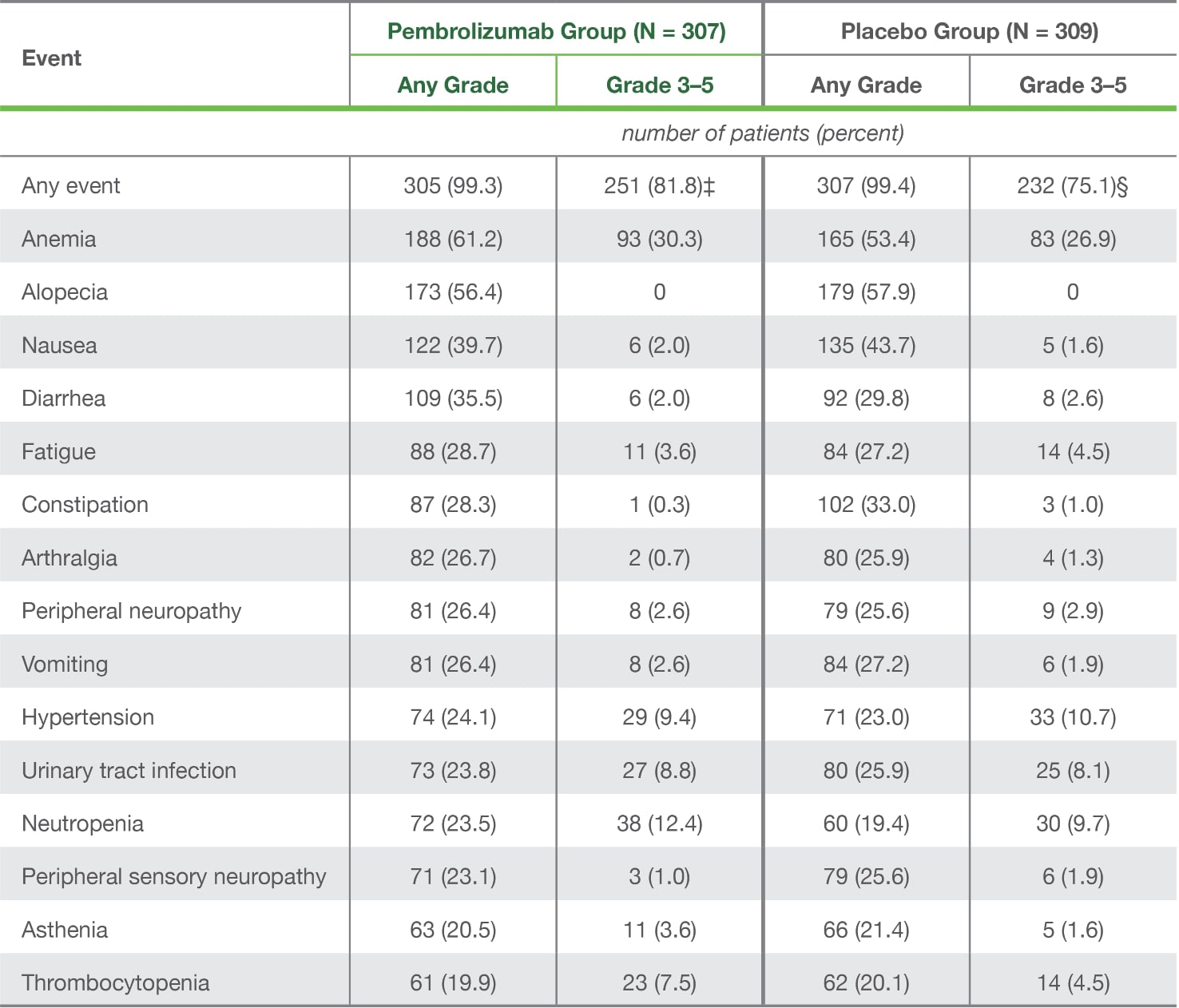
* Shown are adverse events that occurred while patients were receiving trial agents or within 30 days after the end of the trial treatment period (or, for serious events, within 90 days after the end of trial treatment or within 30 days if the patient initiated new anticancer therapy). The as-treated population included all the patients who underwent randomization and received at least one dose of pembrolizumab or placebo. Events are listed in descending order of frequency in the pembrolizumab group. Adverse events were classified according to the Medical Dictionary for Regulatory Activities, version 24.0.
‡ The maximum grade was grade 3 for 167 patients (54.4%), grade 4 for 70 patients (22.8%), and grade 5 for 14 patients (4.6%).
§ The maximum grade was grade 3 for 176 patients (57.0%), grade 4 for 42 patients (13.6%), and grade 5 for 14 patients (4.5%).
Sikkerhetsresultater
Sikkerhetsprofilen til KEYTRUDA® ved vedvarende, tilbakevendende eller metastatisk livmorhalskreft samsvarer med kjente bivirkninger for hver individuell behandling, og med de som er observert i andre kombinasjonsstudier med KEYTRUDA®.
Oppsummering av sikkerhetsprofilen til KEYTRUDA®
KEYTRUDA® er vanligst assosiert med immunrelaterte bivirkninger. Som oftest er immunrelaterte bivirkninger relatert til behandling med KEYTRUDA® reversible og håndteres ved seponering av KEYTRUDA®, administrering av kortikosteroider og/eller støttende behandling5.
Se utfyllende informasjon i preparatomtalen, i utvalgt sikkerhetsinformasjon og bivirkninger.
Forkortelser:
PD-L1 = programmert-døds ligand 1
OS = total overlevelse
CPS = kombinert positiv score
KI = konfidensintervall
NR = ikke nådd
HR = hazard ratio
ORR = objektiv responsrate
DOR = varighet av respons
RECIST = responsevalueringskriterier i avanserte solide svulster
ECOG = Eastern Cooperative Oncology Group
PS = ytelsesstatus
IV = intravenøs infusjon
Q3W = var tredje uke
AUC = arealet under kurven
Har du spørsmål rundt KEYTRUDA®?
Ta kontakt med oss.
Referanser
- https://nyemetoder.no/metoder/pembrolizumab-keytruda-indikasjon-xxii
- https://nhi.no/sykdommer/kreft/gynekologisk-kreft/livmorhalskreft/
- https://www.kreftregisteret.no/Generelt/Rapporter/Cancer-in-Norway/cancer-in-norway-2021/
- Colombo N, Dubot C, Lorusso D, et al. Pembrolizumab for persistent, recurrent, or metastatic cervical cancer. N Engl J Med. 2021;385(20):1856-1867. do: 10.1056/NEJMoa2112435
- Keytruda SPC,Mar 2023, pkt. 5.1 og pkt. 4.1-4.8



