I kombinasjon med aksitinib
Studien KEYNOTE-426
Primære og sekundære effektmål1
Effekt og sikkerhet av KEYTRUDA® i kombinasjon med aksitinib ble undersøkt i KEYNOTE-426- studien, en åpen, randomisert, aktivt kontrollert multisenterstudie.
Studien inkluderte 861 pasienter med avansert klarcellet RCC uavhengig av status av PD-L1-uttrykk i tumor og International Metastatic RCC Database Consortium (IMDC) risikogruppering.
De primære effektmålene var overlevelse (OS) og progresjonsfri overlevelse (PFS), vurdert ved BICR ved bruk av RECIST 1.1. Sekundære effektmål var komplett og partiell responsrate (ORR) og responsvarighet, vurdert ved BICR ved bruk av RECIST 1.1.
Effektresultater fra den prespesifiserte interimanalysen med median oppfølgingstid på 12,8 måneder er oppsummert under1,2.
Signifikant forbedret progresjonsfri overlevelse (PFS)1,2
KEYTRUDA® i kombinasjon med aksitinib viste signifikant forbedret PFS (15.1 vs. 11.0 måneder) vs sunitinib ved førstelinjebehandling av nyrecellekarsinom (RCC).
- Observerte hendelser: 183/432 (42 %) med KEYTRUDA® + aksitinib vs 212/429 (49 %) med sunitinib.
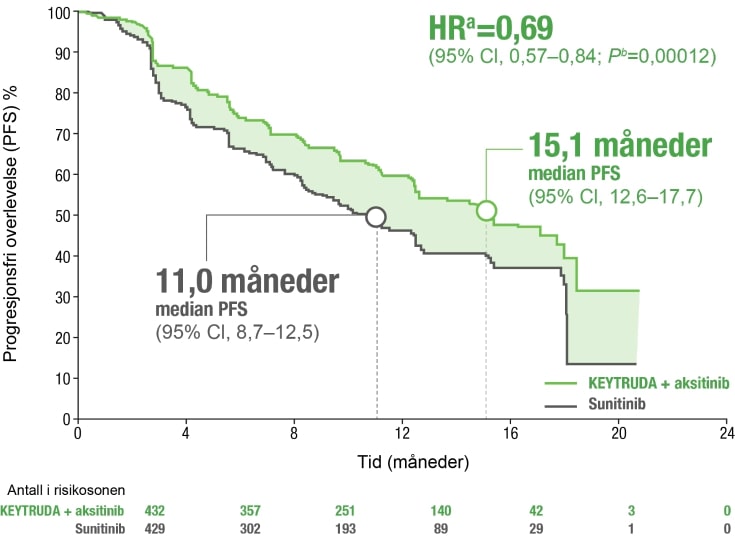
a) Basert på den stratifiserte Cox proportional hazard-modellen
b) Basert på stratifisert log-rank test
OS=Overlevelse, HZ=Hazardratio, CI=Konfidensintervall
Redusert risiko for død (OS)1,2
KEYTRUDA® i kombinasjon med aksitinib viste 47 % redusert risiko for død vs sunitinib etter 12 mnd ved førstelinjebehandling av RCC.
- Observerte hendelser: 59/432 (14 %) med KEYTRUDA® + aksitinib vs 97/429 (23 %) med sunitinib.
- Median OS ble ikke oppnådd med KEYTRUDA® + aksitinib eller med sunitinib.
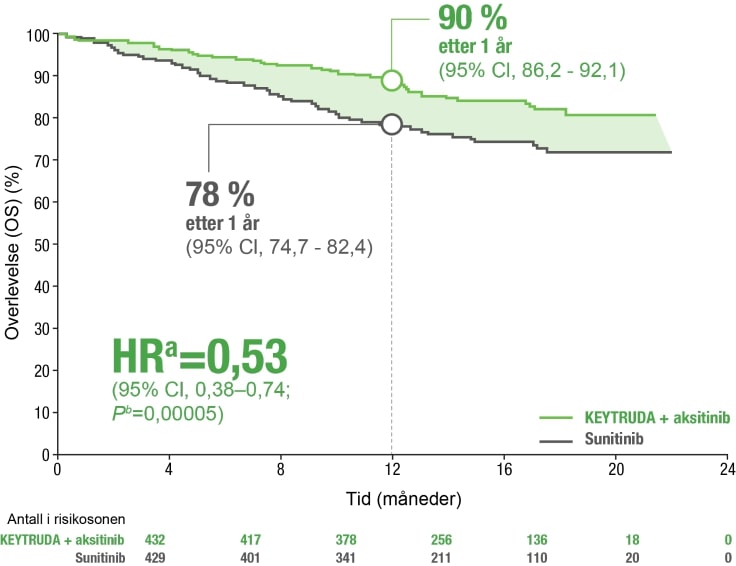
Kaplan-Meier estimat av OS
a) Basert på den stratifiserte Cox proportional hazard-modellen
b) Basert på stratifisert log-rank test
OS=Overlevelse, HZ=Hazardratio, CI=Konfidensintervall
Objektiv responsrate (ORR)2
KEYTRUDA® i kombinasjon med aksitinib viste ORR hos nesten 6/10 pasienter vs sunitinib ved førstelinjebehandling av RCC2.
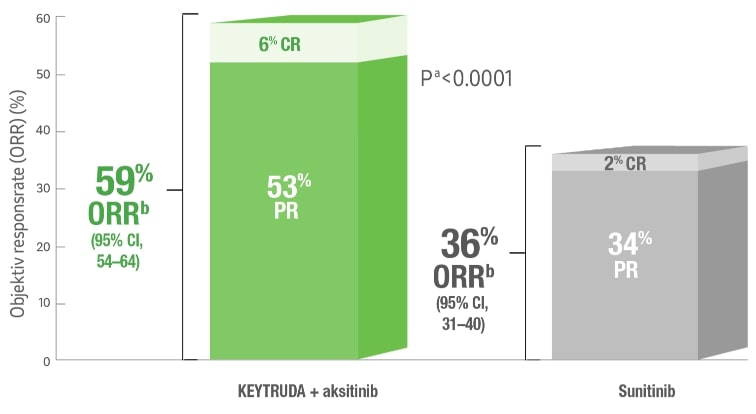
a) Basert på Miettinen og Nurminens metode stratifisert ved IMDC risikogruppering og geografisk region CI=konfidensintervall, CR=komplett respons, IMDC = International Metastatic RCC Database Consortium ORR=Objektiv responsrate, PR=Delvis respons.
Statistisk analyse er ikke gjennomført.
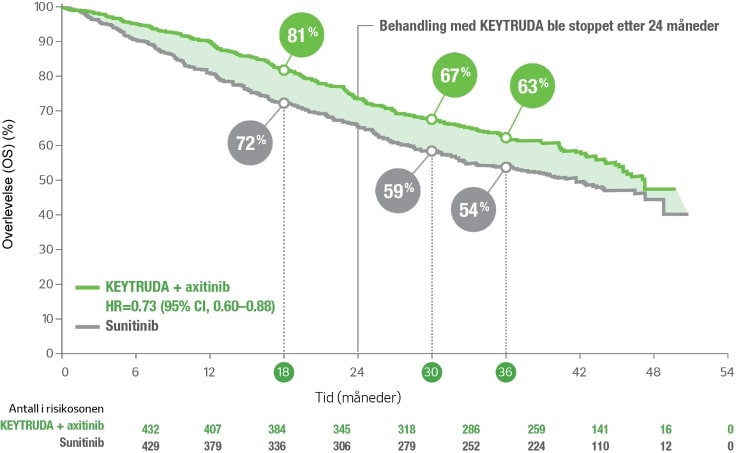
Effektdata med median oppfølgingstid på 37,7 måneder1
De foreløpige dataene er hentet inn fra en forlengelse av KEYNOTE-426-studien. Det er ikke utført formell statistisk testing i forbindelse med den forhåndsspesifiserte analysen, og derfor kan ingen endelige konklusjoner trekkes.
- Median OS: 45,7 måneder (95 % CI, 43,6; NA) med KEYTRUDA®+aksitinib vs 40,1 måneder (95 % CI, 34,3 ; 44,2) med sunitinib.
- Hendelser observert: 193/432 (44,7 %) med KEYTRUDA®+aksitinib vs 225/429 (52,4 %) med sunitinib.
- Median DOR var 23,6 måneder (1,4+; 43,4) med KEYTRUDA® + aksitinib vs 15.3 måneder (2,3; 42,8+) med sunitinib.
- Objektiv responsrate (95 % CI) var 60 % (56; 65) med Keytruda+aksitinib vs 40 % (35; 44) for sunitinib, med en komplett og partiell respons ratio på hhv 10 % og 50 % vs 3 % og 36 %.
Kaplan-Meier estimat av overlevelse (OS)
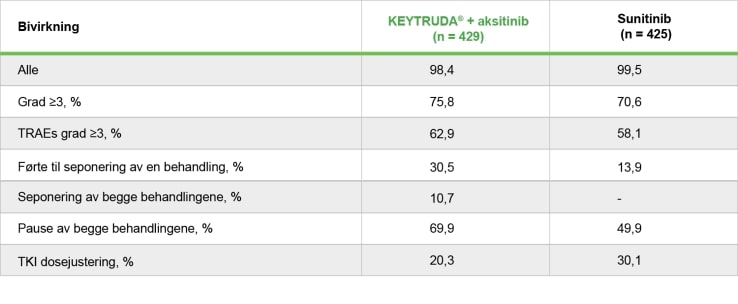
Bivirkninger i KEYNOTE-426-studien2
- Median tid til seponering av behandling av både aksitinib og KEYTRUDA® på grunn av bivirkninger var 105.5 dager.
- Median tid til seponering av behandling for KEYTRUDA® på grunn av bivirkninger var 65 dager.
Oppsummering av sikkerhetsprofilen til KEYTRUDA®1
Pembrolizumab (KEYTRUDA®) er vanligst assosiert med immunmedierte bivirkninger. De fleste immunmedierte bivirkninger som forekom under behandling med KEYTRUDA® var reversible og ble håndtert ved seponering av KEYTRUDA®, administrering av kortikosteroider og/eller støttende behandling1.
Se utfyllende informasjon i preparatomtalen, i utvalgt sikkerhetsinformasjon og bivirkninger.
Studiedesign KEYNOTE-4261,2
Pasientene ble randomisert (1:1) til en av følgende behandlingsarmer i illustrasjonen under.
Randomiseringen ble stratifisert etter risikogruppering (god vs. intermediær vs. dårlig) og geografisk region (Nord-Amerika vs. Vest-Europa vs. «resten av verden»).

a) Pasienter som tolererte aksitinib 5 mg to ganger daglig ved 2 etterfølgende behandlingssykluser (6 uker) uten behandlingsrelaterte bivirkninger > grad 2 for aksitinib og med blodtrykk godt kontrollert til ≤ 150/90 mm Hg, ble tillatt doseøkning av aksitinib til 7 mg to ganger daglig. Doseøkning av aksitinib til 10 mg to ganger daglig ble tillatt ved bruk av de samme kriteriene. Aksitinib kunne tilbakeholdes eller reduseres til 3 mg to ganger daglig og videre til 2 mg to ganger daglig for håndtering av toksisitet.
Dosering1
Når KEYTRUDA® administreres i kombinasjon med aksitinib, henvises det til SPC for aksitinib før behandlingsstart: Inlyta «Pfizer» – Felleskatalogen
KEYTRUDA kan gis hver 3. eller 6.uke. Les mer om dosering her: Keytruda – Dosering | MSD Innsikt
Har du spørsmål rundt KEYTRUDA®?
Ta kontakt med meg.

Vedrana Grcic-van de Pavert – Brand & Customer Manager

Bente Arvesen – Key Account Manager Oncology
Referanser
- Keytruda SPC, oktober 2024, 4.1, 4.2, 5.1.
- Rini BI, Plimack ER, Stus V, et al. Pembrolizumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med. 2019;380(12):1116–1127.